Glioblastoma: un nuovo studio fa luce sul meccanismo con cui questo tumore invade i tessuti
Lo studio, pubblicato su Neuro Oncology, ha scoperto un meccanismo che potenzia la capacità del glioblastoma di migrare e infiltrarsi all’interno dei tessuti, aprendo la strada per future terapie.
Il glioblastoma è una forma molto aggressiva di tumore al cervello: anche oggi, le persone a cui viene diagnosticato hanno, grazie alle terapie attuali, una sopravvivenza media tra i 10 e i 13 mesi. Meno del 10% dei pazienti sopravvive a 5 anni dalla diagnosi. Uno dei problemi che rendono questa patologia particolarmente difficile da curare è l’alta incidenza di recidive. Le cellule del glioblastoma, infatti, tendono a infiltrarsi all’interno del tessuto circostante e, nonostante la rimozione chirurgica e il trattamento con chemioterapia e radioterapia, possono innescare di nuovo la proliferazione del tumore.
Un nuovo studio pubblicato su Neuro Oncology, guidato da Matteo Tamborini, Valentino Ribecco ed Elisabetta Stanzani, ha indagato i meccanismi che regolano l’infiltrazione delle cellule del glioblastoma nel tessuto circostante, riuscendo a dimostrarne il funzionamento in diversi contesti: in vitro, in vivo e su organoidi che riproducono tridimensionalmente il tessuto nervoso umano. La ricerca di Humanitas in ambito neuro-oncologico è possibile anche grazie al sostegno di Fondazione Humanitas per la Ricerca e alla collaborazione con i gruppi clinici guidati da Federico Pessina e Marco Riva (Neurochirurgia) e da Letterio Salvatore Politi (Radiodiagnostica),
“Questi risultati sono importanti perché identificano alcuni meccanismi cellulari che sembrano essere alla base dell’invasività di uno dei tumori più aggressivi”, spiega Michela Matteoli – Direttrice del programma di Neuroscienze presso l’IRCCS Istituto Clinico Humanitas.
Come si diffonde il glioblastoma
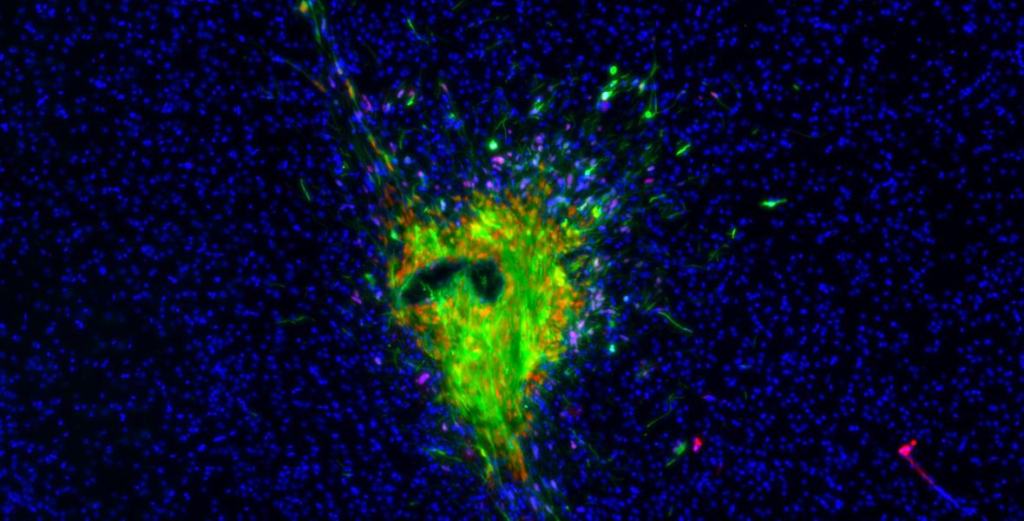
Il gruppo di ricercatori di Humanitas si è concentrato su una delle strategie che le cellule tumorali del glioblastoma usano per comunicare tra di loro e con l’ambiente circostante, cioè la produzione di vescicole extracellulari. Queste vescicole extracellulari si formano gemmando dalla membrana della cellula tumorale e contengono informazioni derivate dalla cellula stessa. Una volta formate, le vescicole possono fondersi ad altre cellule del tessuto circostante e trasmettere segnali che possono modificarne alcune funzioni. In particolare, Tamborini, Ribecco, Stanzani e i loro colleghi, tra cui Lorena Passoni e Giuseppe Martano di Humanitas, si sono concentrati sull’effetto che queste vescicole hanno sulle stesse cellule tumorali, scoprendo che le vescicole innescano un aumento significativo nella loro capacità di migrazione. Le vescicole prodotte dal tumore, quindi, sono in grado di facilitarne e potenziarne l’infiltrazione nel tessuto circostante.
“Una delle domande che ci siamo posti è come fa la vescicola a conferire questa capacità alla cellula ricevente”, spiega Matteo Tamborini. Analizzando le cellule dopo la somministrazione delle vescicole, i ricercatori hanno identificato una proteina chiave coinvolta nel processo, la connessina 43. “È proprio attraverso questa proteina che le microvescicole riescono ad attivare il segnale di motilità cellulare nel tumore: un potenziale target terapeutico per rallentarne la migrazione.”
Un lavoro collaborativo
Il programma di Neuroscienze guidato da Michela Matteoli lavora da anni in collaborazione con i neurochirurghi di Humanitas per raccogliere i tessuti tumorali di pazienti affetti da glioblastoma: una collaborazione che ha permesso di sviluppare linee cellulari derivate dai pazienti. “Sono cellule staminali tumorali”, spiega Michela Matteoli. “Oggi grazie a questa collaborazione abbiamo una banca che conta più di 60 linee cellulari umane, derivate da pazienti”. Questa banca di linee cellulari è stata cruciale per i ricercatori impegnati nello studio pubblicato su Neuro Oncology.
“La collaborazione con i neurochirurghi di Humanitas è stata preziosissima”, spiega Elisabetta Stanzani, “perché ci ha fornito non solo il tessuto tumorale del paziente, ma anche il cosiddetto aspirato chirurgico, risorsa per noi fondamentale perché contiene le microvescicole prodotte dal tumore, rilasciate nel tessuto in un contesto di rilevanza clinica”. Con le cellule staminali tumorali prelevate dal paziente, i ricercatori hanno generato le linee di cellule studiate in coltura. Hanno poi utilizzato le vescicole isolate dall’aspirato chirurgico per attivare le linee di cellule tumorali, dimostrando come queste vescicole siano in grado di influenzare la progressione della malattia.
Una parte importante della ricerca è stata svolta in collaborazione con Simona Lodato, che guida il Neurodevelopmental Biology Lab presso l’IRCCS Istituto Clinico Humanitas. Il laboratorio di Lodato ha prodotto organoidi cerebrali formati da colture tridimensionali di cellule umane ai quali è stato integrato il tumore stesso: questo ha permesso ai ricercatori di analizzare il meccanismo alla base della diffusione del glioblastoma non solo in vitro e in modelli sperimentali, ma anche in una architettura 3D composta da cellule neuronali umane.
“Le vescicole hanno un ruolo forte nell’indurre la migrazione del glioblastoma”, commenta Michela Matteoli. “Questo significa che alcuni dei meccanismi molecolari che abbiamo identificato grazie a questo studio collaborativo – dal rilascio delle vescicole all’interazione con il tumore tramite connessina – possono essere utilizzati come bersaglio farmacologico in future terapie”.
